Leyes de los gases
Introducción
Una propiedad de una cantidad de materia es algo que podemos medir con respecto a esa cantidad de materia. Entre las propiedades mas comúnmente experimentadas están : la masa, el volumen, la forma, la temperatura, el color, sabor, olor y textura. El conjunto total de propiedades define al objeto.
Un gas es un estado homogéneo de agregación de la materia en que esta tiene la forma y el volumen del recipiente que la contiene. Todos los gases, idealmente se comportan en forma similar ante los cambios de presión y temperatura, pudiéndose expansionar y comprimir entre limites muy amplios, cosa imposibles en liquido y solido.
Los gases, aunque lentamente, tienden a interpretarse entre si , lo que los hacen miscibles en todas proporciones, por esto las mezclas gaseosas son totalmente homogéneas. Para describir y caracterizar un gas es indispensable especificar la temperatura y presión a que se mide su volumen .

| Distintas materias, distintas fuerzas de cohesión molecular. |
En el estado sólido la fuerza de cohesión de las moléculas hace que estas estén muy próximas unas de otros con escaso margen de movimiento entre ellas.
En el estado líquido esta fuerza de cohesión molecular es menor lo cual permite mayor libertad de movimiento entre ellas.
En el estado gaseoso la fuerza de cohesión de las moléculas es muy pequeña, prácticamente nula, lo cual permite que estas se muevan libremente y en todas direcciones.
En este capítulo nos dedicaremos a estudiar este comportamiento de los gases para encontrar una explicación al mismo.
Antes de entrar de lleno en el estudio de las leyes que ocupan el compartimento de las leyes , veamos cómo influyen en este los eventos físicos que los alteran y que son: temperatura, presión y volumen , además de la cantidad de que se trate.
La determinación de una ecuación de estado de los gases implica inevitablemente la medición de la presión , o fuerza por unidad de área, que un gas ejerce sobre las paredes del recipiente que lo contiene. La presión de los gases comúnmente se expresa en atmósferas o milímetros de mercurio.
Objetivos
Este blog tiene como objetivo principal brindarle al lector, explicación y un breve análisis de los gases así como sus leyes y aplicaciones las cuales se han implementado a lo largo de la historia.
1. Conocer cuales son las leyes de los gases, sus formulas, quienes la crearon, entre otras cosas..
2. Explicar las propiedades de los gases ideales y las leyes que rigen su comportamiento.
3 Deducir la ley combinada de los gases
4.Explicar la idea del mol.
5. Aprender nuevos conceptos de química
6. Aprender a desarrollar diferentes ejercicios de leyes de los gases
Marco Teórico
Estados de agregación
Los estados de agregación, sólido, líquido y gaseoso, dependen fundamentalmente de las condiciones de presión y temperatura a las que esté sometida la materia.
Estado solido
En el estado solido los átomos o moléculas ocupan posiciones fijas aunque se encuentran vibrando en esas posiciones con una capacidad de movimiento limitada.
|
Los sólidos se caracterizan por tener forma y volumen constantes. Esto se debe a que las partículas que los forman están unidas por unas fuerzas de atracción grandes de modo que ocupan posiciones casi fijas. En el estado sólido las partículas solamente pueden moverse vibrado u oscilando alrededor de posiciones fijas, pero no pueden moverse trasladándose libremente a lo largo del sólido. Las partículas en el estado sólido propiamente dicho, se disponen de forma ordenada, con una regularidad espacial geométrica, que da lugar a diversas estructuras cristalinas Al aumentar la temperatura aumenta la vibración de las partículas: |
Estado Liquido
En el estado liquido la fuerza de cohesión que mantiene unidas a las moléculas es mucho menor.
En un líquido las moléculas tienen una cierta capacidad de movimiento que, en gran medida, está limitada por las otras moléculas que tienen alrededor.
|
Los líquidos, al igual que los sólidos, tienen volumen constante. En los líquidos las partículas están unidas por unas fuerzas de atracción menores que en los sólidos , por esta razón las partículas de un líquido pueden trasladarse con libertad. El número de partículas por unidad de volumen es muy alto, por ello son muy frecuentes las colisiones y fricciones entre ellas. Así se explica que los líquidos no tengan forma fija y adopten la forma del recipiente que los contiene. También se explican propiedades como la fluidez o la viscosidad. En los líquidos el movimiento es desordenado, pero existen asociaciones de varias partículas que, como si fueran una, se mueven al unísono. Al aumentar la temperatura aumenta la movilidad de las partículas (su energía) |
Estado gaseoso
| En un gas las moléculas se encuentran muy lejanas unas de otras y se mueven en todas direcciones con libertad absoluta. |
Los gases, igual que los líquidos, no tiene forma fija pero, a diferencia de éstos, su volumen tampoco es fijo . También son fluidos , como los líquidos. En los gases,las fuerzas que mantienen unidas por las partículas son muy pequeñas. En un gas el número de partículas por unidad de volumen es también muy pequeño. Las partículas se mueven de forma desordenada, con choques entre ellas y con las paredes del recipiente que los contiene. Esto explica las propiedades de expansibilidad y comprensibilidad que presentan los gases: sus partículas se mueven libremente, de modo que ocupan todo el espacio disponible. La compresibilidad tiene un límite, si se reduce mucho el volumen en que se encuentra confinado un gas éste pasará a estado líquido. Al aumentar la temperatura las partículas se mueven más deprisa y chocan con más energía contra las paredes del recipiente, por lo que aumenta la presión. En este laboratorio vamos a profundizarlos y estudiar mas acerca de el comportamiento de los gases y conocer sus leyes |
Gases

Los gases son el estado de agregación de la materia, en el cual, bajo ciertas condiciones de temperatura y presión sus moléculas interaccionan solo débilmente entre sí, sin formar enlaces moleculares, adoptando la forma y el volumen del recipiente que las contiene y tendiendo a separarse, esto es, expandirse, todo lo posible por su alta concentración de energía cinética Los gases son fluidos altamente comprensibles, que experimentan grandes cambios de densidad con la presión y la temperatura.
Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, explicando así las propiedades:
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a la que se mueven sus moléculas.
- Los gases ocupan completamente el volumen del recipiente que los contiene.
- Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
- Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
A temperatura y presión los gases pueden ser elementos como el hidrógeno, el oxígeno, el nitrógeno, el cloro, el flúor y los gases nobles compuestos como el dióxido de carbono o el propano, o mezclas como el aire.
Los vapores y el plasma comparten propiedades con los gases y pueden formar mezclas homogéneas, por ejemplo vapor de agua y aire, en conjunto son conocidos como cuerpos gaseosos , estado gaseoso o fase gaseosa.
Características de los gases
1. Los gases no tienen ni forma no volumen propios.
2. son fácilmente comprensibles
3. Forman con otros gases mezclas homogéneas.
4 Ocupan una fracción mínima del volumen del recipiente que los contiene.
¿Qué propiedades tienen los gases?
En los gases, las fuerzas de atracción son casi inexistentes, por lo que las partículas están muy separadas unas de otras y se mueven rápidamente y en cualquier dirección, trasladándose incluso a largas distancias.
Esto hace que los gases tengan las siguientes propiedades:
1.1- No tienen forma propia: No tienen forma propia, pues se adaptan al recipiente que los contiene.
1.2- Se dilatan y contraen: como los sólidos y líquidos.
1.3- Fluidez :Es la propiedad que tiene un gas para ocupar todo el espacio debido a que, prácticamente, no posee fuerzas de unión entre las moléculas que lo conforman.Por ejemplo Cuando hay un gas encerrado en un recipiente, como un globo, basta una pequeña abertura para que el gas pueda salir.


1.4- Difusión :Es el proceso por el cual un gas se mezcla con otro debido únicamente al movimiento de sus moléculas.
Por ejemplo: un escape de gas desde un balón, este tiende a ocupar todo el espacio donde se encuentra mezclándose con el aire.
1.5- Compresión:La compresión es la disminución del volumen de un gas porque sus moléculas se acercan entre si, debido a la presión aplicada.
Por ejemplo: Se puede observar cuando presionas el émbolo de una jeringa mientras tienes tapada su salida.

1.6- Resistencia
Es la propiedad de los gases de oponerse al movimiento de los cuerpos por el aire. Esto se debe a una fuerza llamada fuerza roce. A mayor tamaño y velocidad del cuerpo mayor es la resistencia.
Por ejemplo: un paracaídas o al elevar un volatín, el roce con el aire impide que el volatín caiga al suelo.
Temperatura

Según la teoría cinética, la temperatura es una medida de la energía cinética media de los átomos y moléculas que constituyen un sistema. Dado que la energía cinética depende de la velocidad, podemos decir que la temperatura está relacionada con las velocidades medias de las moléculas del gas.
Hay varias escalas para medir la temperatura entre estas estas estan:
1 Kelvin
2 Celsius
3 Fahernheit
Punto de fusión del agua:
La fase líquida se encuentra en equilibrio con la fase sólida y la temperatura permanece constante.
Los valores otorgados a este punto en cada escala son:
| |
Punto de ebullición del agua:
La fase líquida se encuentra en equilibrio con la fase gaseosa y la temperatura permanece constante.
Los valores otorgados a este punto en cada escala son:
|
En el intervalo de temperatura comprendido entre los puntos de fusión y ebullición, el agua permanece líquida. Este intervalo se divide en 100 partes en las escalas Celsius y Kelvin, mientras que en la escala Fahrenheit se divide en 180 partes.
| Presión = 1 atm | P.F. del agua | P.E. del agua | Divisiones |
| Escala Celsius | 0 | 100 | 100 |
| Escala Kelvin | 273.15 | 373.15 | 100 |
| Escala Fahrenheit | 32 | 212 | 180 |
| Relación entre las escalas |
| T(K) = T(°C) + 273.15 |
| T(°F) = T(°C)·1.8 + 32 |
Presión
En Física, llamamos presión a la relación que existe entre una fuerza y la superficie sobre la que se aplica:
Dado que en el Sistema Internacional la unidad de fuerza es el newton (N) y la de superficie es el metro cuadrado (m2), la unidad resultante para la presión es el newton por metro cuadrado (N/m2) que recibe el nombre de pascal (Pa)
Según la teoría cinética, la presión de un gas es otra unidad muy utilizada para medir la presión, aunque no pertenece al Sistema Internacional, es el milímetro de mercurio (mm Hg) que representa una presión equivalente al peso de una columna de mercurio de 1 mm de altura. Esta unidad está relacionada con la experiencia de Torricelli que encontró, utilizando un barómetro de mercurio, que al nivel del mar la presión atmosférica era equivalente a la ejercida por una columna de mercurio de 760 mm de altura.
En este trabajo usaremos la atmósfera (atm) y el milímetro de mercurio (mmHg):
1atm=760mmHg
Volumen
El volumen es el espacio que ocupa un sistema. Recuerda que los gases ocupan todo el volumen disponible del recipiente en el que se encuentran. Decir que el volumen de un recipiente que contiene un gas ha cambiado es equivalente a decir que ha cambiado el volumen del gas.
En el laboratorio se utilizan frecuentemente jeringuillas como recipientes de volumen variable cuando se quiere experimentar con gases.
Hay muchas unidades para medir el volumen. En este trabajo usaremos el litro (L) y el mililitro (mL)
Su equivalencia es:
1L = 1000 mL
Como 1 L es equivalente a 1 dm3, es decir a 1000 cm3, tenemos que el mL y el cm3 son unidades equivalentes.
Cantidad de gas
La La cantidad de gas está relacionada con el número total de moléculas que se encuentran en un recipiente. La unidad que utilizamos para medir la cantidad de gas es el mol.
Un mol es una cantidad igual al llamado número de Avogadro:
1 mol de moléculas= 6,022·1023 moléculas
1 mol de átomos= 6,022·1023 átomos
¡¡¡ 602.200.000.000.000.000.000.000 !!!
La masa molar de una sustancia pura es la masa que corresponde a 1 mol de dicha sustancia:
Con el siguiente simulador puedes calcular las masas molares de algunas sustancias puras como el hidrógeno, el metano, el cloro y el yodo. La medida es correcta cuando se enciende el testigo rojo.
Vamos a explicar 5 de las leyes vistas en clase :
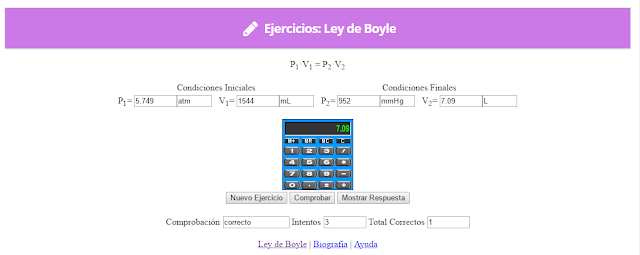
Ley de Boyle
Fue descubierta por Robert Boyle en 1662. Edme Mariotte también llegó a la misma conclusión que Boyle, pero no publicó sus trabajos hasta 1676. Esta es la razón por la que en muchos libros encontramos esta ley con el nombre de Ley de Boyle y Mariotte.
La ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante.
¿Por qué ocurre esto?
Al aumentar el volumen, las partículas (átomos o moléculas) del gas tardan más en llegar a las paredes del recipiente y por lo tanto chocan menos veces por unidad de tiempo contra ellas. Esto significa que la presión será menor ya que ésta representa la frecuencia de choques del gas contra las paredes.
Cuando disminuye el volumen la distancia que tienen que recorrer las partículas es menor y por tanto se producen más choques en cada unidad de tiempo: aumenta la presión.
Lo que Boyle descubrió es que si la cantidad de gas y la temperatura permanecen constantes, el producto de la presión por el volumen siempre tiene el mismo valor.
Como hemos visto, la expresión matemática de esta ley es:
(el producto de la presión por el volumen es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una presión P1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la presión cambiará a P2, y se cumplirá:
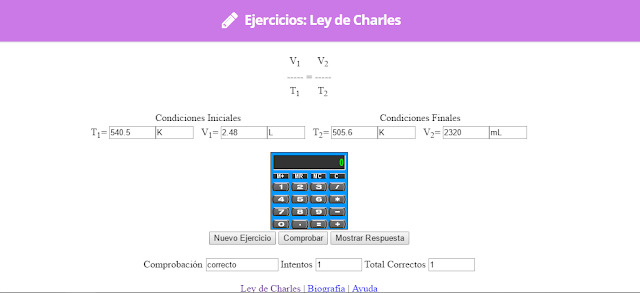
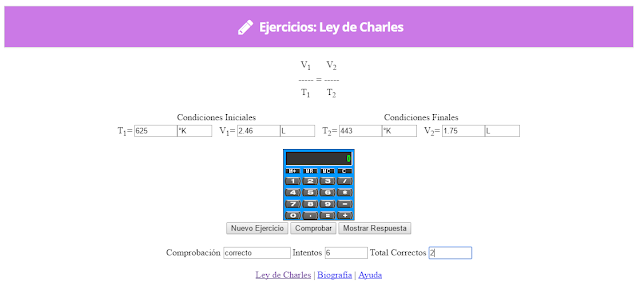
Ley de Charles
En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuía.
Por qué ocurre esto?
Cuando aumentamos la temperatura del gas las moléculas se mueven con más rapidez y tardan menos tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número de choques por unidad de tiempo será mayor. Es decir se producirá un aumento (por un instante) de la presión en el interior del recipiente y aumentará el volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale con la exterior).
Lo que Charles descubrió es que si la cantidad de gas y la presión permanecen constantes, el cociente entre el volumen y la temperatura siempre tiene el mismo valor.
Matemáticamente podemos expresarlo así:
(el cociente entre el volumen y la temperatura es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una temperatura T1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la temperatura cambiará a T2, y se cumplirá:
que es otra manera de expresar la ley de Charles.
Esta ley se descubre casi ciento cuarenta años después de la de Boyle debido a que cuando Charles la enunció se encontró con el inconveniente de tener que relacionar el volumen con la temperatura Celsius ya que aún no existía la escala absoluta de temperatura.
Gases ideales
En primer lugar empezamos diciendo que un gas ideal será aquel en el que las moléculas que lo forman tienen volumen cero y los choques entre ellas son perfectamente elásticos.
Los gases ideales no existen aunque podemos considerar que los gases de masa molecular no muy alta a presiones no muy bajas y a temperaturas no excesivamente bajas se comportan como gases ideales.
Para tener mas claro este tema veremos el siguiente tutorial
Ley Gay-Lussac
Fue enunciada por Joseph Louis Gay-Lussac a principios de 1800.
Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante.¿Por qué ocurre esto?
Al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Gay-Lussac descubrió que, en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valor:
(el cociente entre la presión y la temperatura es constante)
Supongamos que tenemos un gas que se encuentra a una presión P1 y a una temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y se cumplirá:
que es otra manera de expresar la ley de Gay-Lussac.
Esta ley, al igual que la de Charles, está expresada en función de la temperatura absoluta. Al igual que en la ley de Charles, las temperaturas han de expresarse en Kelvin.
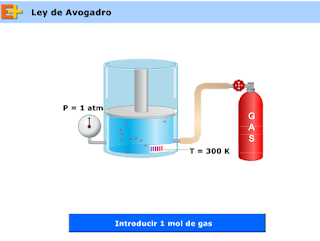
Ley Avogadro
Esta ley, descubierta por Avogadro a principios del siglo XIX, establece la relación entre la cantidad de gas y su volumen cuando se mantienen constantes la temperatura y la presión. Recuerda que la cantidad de gas la medimos en moles.
El volumen es directamente proporcional a la cantidad de gas:
- Si aumentamos la cantidad de gas, aumentará el volumen.
- Si disminuimos la cantidad de gas, el volumen disminuye.
¿Por qué ocurre esto?
Vamos a suponer que aumentamos la cantidad de gas. Esto quiere decir que al haber mayor número de moléculas aumentará la frecuencia de los choques con las paredes del recipiente lo que implica (por un instante) que la presión dentro del recipiente es mayor que la exterior y esto provoca que el émbolo se desplace hacia arriba inmediatamente. Al haber ahora mayor distancia entre las paredes (es decir, mayor volumen del recipiente) el número de choques de las moléculas contra las paredes disminuye y la presión vuelve a su valor original.
Según hemos visto en la animación anterior, también podemos expresar la ley de Avogadro así:
(el cociente entre el volumen y la cantidad de gas es constante)
Supongamos que tenemos una cierta cantidad de gas n1 que ocupa un volumen V1 al comienzo del experimento. Si variamos la cantidad de gas hasta un nuevo valor n2, entonces el volumen cambiará a V2, y se cumplirá:
Ejercicios de QUÍMICA
Ley de Boyle
a)
b)
d)
e)
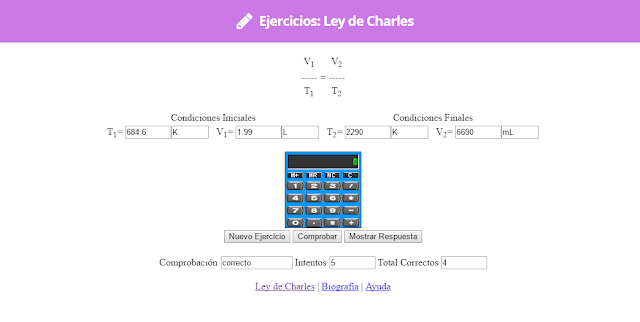
Ley de charles
a)
b)
c)
d)
e)
Gases ideales
a)
b)
c)
Ley de Gay Lussac
b)
c)
Ley de Avogadro
a)
b)
c)












































No hay comentarios:
Publicar un comentario